がんの早期検出は患者の生存率を向上させる鍵となりますが、既存の技術には感度と特異性が不十分であるという課題があります。多くの方法は侵襲的な検査に依存しているか、偽陽性率が高いため、その広範な適用は制限されています。近年、リキッドバイオプシー技術はその非侵襲性により多くの注目を集めていますが、深層標的配列決定における限界もまた、その開発を制限しています。
がん治療において早期発見は常に難しい問題です。近年、非侵襲性と感度の高さからリキッドバイオプシー技術が広く注目を集めています。しかし、既存の検出技術は主にディープターゲットシーケンシングに依存しており、複数のデータタイプを統合することが難しいため、感度と特異性に影響を与えます。
この技術的欠点に対応して、オックスフォード大学の研究チームは、ゲノムワイドな TET 支援ピリジンボラン配列決定 (TAPS) に基づいた新しいマルチモーダル循環腫瘍 DNA (ctDNA) 検出法を開発しました。この方法の最大のハイライトは、ゲノムとメチル化データを同時に分析できることで、がん診断の感度は 94.9%、特異度は 88.8% に達します。この画期的なテクノロジーは、早期がんスクリーニングと患者層別化に新たな可能性をもたらします。
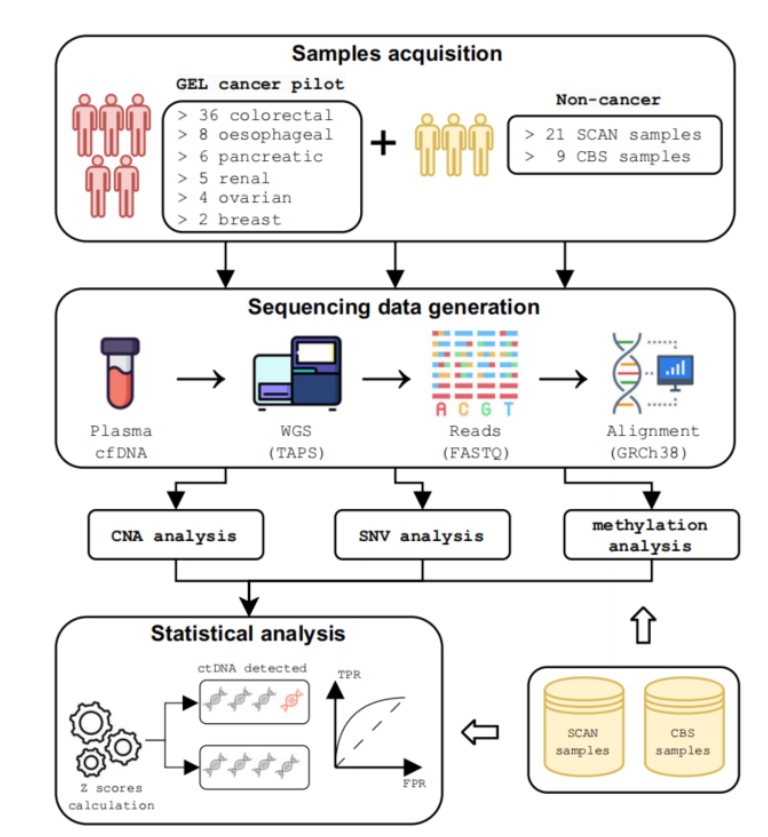
この研究は「多峰性無細胞DNA全ゲノムTAPSは高感度であり、特定のがんシグナルを明らかにする」と題され、2025年1月8日に雑誌「Nature Communications」に掲載された。研究背景によれば、がんの早期発見は患者の予後を改善するために重要であるが、現在のスクリーニング方法ではがんの種類の 30% 未満しかカバーできず、多くの方法は侵襲的な検査が必要であり、受け入れ度が低いことが示されています。複数のがんの早期検出技術は非侵襲的な検出を実現できますが、無症状の人では偽陽性率が高いことが多く、その応用が制限されています。
オックスフォードチームの TAPS 技術は、非破壊的な方法を使用して、低い ctDNA 含有量でも高い感度を維持します。研究者らは、61人のがん患者と30人の非がん対照から採取したサンプルをディープシーケンスすることにより、複数のがん種におけるこの方法の精度を検証した。
同チームは、ctDNA検出の感度を向上させるために、コピー数の変異、体細胞変異、メチル化シグナルを統合するマルチモーダルデータ分析パイプラインも開発した。その結果、臨床サンプルにおけるこの方法の検出感度は 85.2% に達し、単一のデータモダリティの結果よりもはるかに高いことがわかりました。
この方法は、がんの早期発見と術後のモニタリングにおいて大きな利点を示していますが、実用化には依然として高いシーケンスコストやリソースが限られた臨床現場などの課題に直面しています。今後の研究では、シーケンス技術をさらに最適化し、より多くの種類のがんへの適用可能性を拡大できる可能性があります。
オックスフォード大学チームによるこの研究は、がんの早期発見に新たな希望をもたらし、その高い感度と特異度は、将来のより正確ながん診断と治療のための強固な基盤となります。課題はまだ残っていますが、この技術の進歩は間違いなくがん治療の分野を進歩させ、より多くの患者に利益をもたらすでしょう。